Опорные конспекты, схемы и таблицы по теме «Халькогены»
2NH4N03(n) + Pb2+ + S2-;
Pb(NO3)2(T) + 2NH+ + S2-;
(NH4)2S(т) + Pb2+ + 2NO3-;
PbS(т) + 2NH4+ + 2N03-.
Полное ионное уравнение этой реакции ? .
15. Сульфид меди (II) реагирует с горячей азотной кислотой с образованием оксида азота (II) и свободной серы по реакции
16. Раствор оксида серы (IV) можно использовать в качестве восстановителя. Напишите уравнения всех указанных ниже превращений.
|
Восстановление |
Уравнение реакции |
|
(1) Раствор KMnО4 до MnSO4 (2) Кислый раствор K2Сr2О7 до Cr (3) Раствор нитрата ртути (I) до металлической ртути |
? ? ? |
17. Продукты, полученные после прокаливания смеси серы с железом, растворили в соляной кислоте. При этом произошло полное растворение, и объем выделившихся газов, измеренных при н. у., составил 4,48 л. Газообразные продукты пропустили через раствор нитрата свинца (II), при этом выпало 23,9 г осадка. Исходный состав смеси составлял:
11,2 г Fe, 3,2 г S; (3) 2,8 г Fe, 1,6 г S;
5,6 г Fe, 3,2 г S; (4) 11,2 г Fe, 6,4 г S.
18. При добавлении к подкисленному розовому раствору перманганата калия раствора Na2SO3 происходит:
(1) помутнение в результате выделения свободной серы;
обесцвечивание вследствие образования Мn2+;
выделение пузырьков газа SO2;
окрашивание в темно-зеленый цвет из-за образования МnО42-.
19. Смесь SO2 и С12 реагирует на солнечном свету, при этом образуется:
SO3; (3) SOC12;
SO2C12; (4) S.
20. Тиосульфат натрия имеет формулу. Эту соль получают по реакции /
21. Продуктами взаимодействия серы с указанными на схеме веществами будут являться:
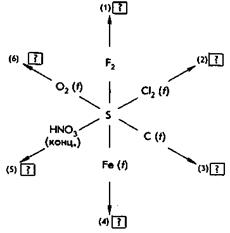
22. От примеси сероводорода очистить водород можно пропусканием последнего через раствор:
соляной кислоты; (3) нитрата свинца (II);
серной кислоты; (4) хлорида натрия.
Карточки 3 уровня
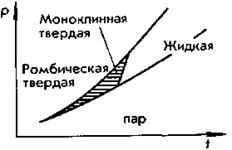
1. Рассмотрите диаграмму состояния серы, т. е. условия превращения твердой серы в жидкое и парообразное состояния в зависимости от давления р и температуры t. Как изменится температура плавления серы при повышении давления:
понизится;
повысится;
не изменится?
2. На рисунке представлено изменение количества вещества (v, моль) реагентов и продуктов реакции получения оксида серы (VI) из оксида серы (IV) по мере достижения равновесия.
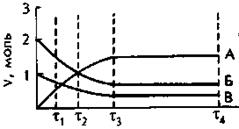
Веществами А, Б и В являются соответственно:
SO3, SO2 и О2; (3) SO3, O2 и SO2;
SO2, O2 и SO3; (4) О2, SO2 и SO3.
3. На приведенном в предыдущем задании рисунке равновесное состояние достигается при значении времени:
t1; (3) t3;
t2; (4) t4.
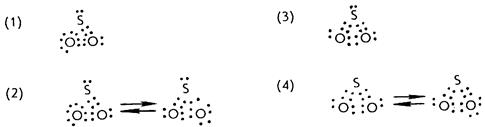
4. Какая из схем наиболее правильно отображает электронную формулу при образовании химической связи в молекуле оксида серы (IV)?
5. В тигле к порошку серы прилили концентрированный раствор гидроксида натрия, после чего смесь кипятили некоторое время. По почернению бумаги, смоченной раствором Pb(NO3)2, установили, что в растворе присутствуют сульфид-ионы, образовавшиеся по реакции ? .
6. Сероводород и неон находятся при одной и той же температуре и давлении. Чему равен объем (л) сероводорода, имеющий такое же число молекул, как и 10,0 л неона:
3,33; (3) 22,4;
10,0; (4) 30,0?
7. В замкнутом сосуде объемом 1,5 л при н. у. находится смесь сероводорода с избытком кислорода. Смесь подожгли; после окончания реакции образовавшиеся продукты растворили в 49,2 см3 воды и получили 1,64%-ный раствор кислоты. В исходной смеси находились:
0,34 л H2S и 1,16 л О2;
0,60 л H2S и 0,90 л О2;
0,44 л H2S и 1,06 л О2;
0,22 л H2S и 1,28 л О2.
8. Ниже представлены теплоты образования (Qo6p, кДж/моль) некоторых сложных веществ из простых (теплота образования простого вещества равна нулю);
|
Газ |
H2S |
O2 |
H2O |
SO2 |
|
Qo6p, кДж/моль |
+21 |
0 |
+286 |
+297 |
Статьи по педагогике:
Аддиктивное поведение - первый шаг к наркозависимости
В последнее время все чаще в социально-педагогической литературе рассматривается понятие «аддиктивное поведение». Мы будем опираться на определение аддиктивного поведения, предложенное С.А. Кулаковым (1989). Автор трактует аддиктивное поведение как злоупотребление одним или несколькими психоактивны ...
Проблемы методики обучения природопользованию
Методика обучения природопользования – одна из педагогических наук, которая в настоящий момент времени только начинает развиваться в полной мере. До настоящего времени, изучив историю развития, ей не уделялось значительного внимания, так как сама дисциплина «Природопользование» появилась по историч ...
Научно-методический анализ учебно-методического комплекса по физике для 11
класса средней школы
Одним из основных средств развития личности и формирования ее базовой культуры выступает содержание образования. В традиционной педагогике, ориентированной на реализацию преимущественно образовательных функций школы, содержание образования определяется как «совокупность систематизированных знаний, ...
Категории
- Главная
- Интенсивность труда
- Гуманная педагогика
- История педагогики и образования
- Уровень обучаемости
- Дистанционное обучение
- Система античного образования
- Образование и воспитание
