Опорные конспекты, схемы и таблицы по теме «Халькогены»
3. Физические свойства. Серная кислота — бесцветная, тяжелая (r =1,84 г/см3), нелетучая жидкость. При растворении ее в воде происходит очень сильное разогревание. Помните, что нельзя вливать воду в концентрированную серную кислоту (рис. 2)! Концентрированная серная кислота поглощает из воздуха водяные пары. В этом можно убедиться, если открытый сосуд с концентрированной серной кислотой уравновесить на весах: через некоторое время чашка с сосудом опустится.
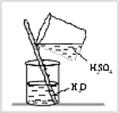
Рис. 2. Приготовление раствора серной кислоты
4. Химические свойства. Разбавленная серная кислота обладает общими свойствами, характерными для кислот и специфическими (табл. 7).
Таблица 7
|
Химические свойства серной кислоты | |
|
Общие с другими кислотами |
Специфические |
|
1. Водный раствор изменяет окраску индикаторов. |
1. Концентрированная серная кислота — сильный окислитель: при нагревании она реагирует почти со всеми металлами (искл. Аu, Pt и нек. др.). В этих реакциях в зависимости от активности металла и условий выделяются SO2, H2S, S, например: Cu+2H2SO4 |
|
2. Разбавленная серная кислота реагирует с металлами: H2SO4+Zn ® ZnSO4+H2 2H+ + SO42-+Zn0 ® Zn2+ + SO42- +H20 2H+ + Zn0 ® Zn2+ + H20 |
2. Концентрированная серная кислота энергично реагирует с водой с образованием гидратов: H2SO4 + nH2O ® H2SO4 × nН2О+ Q Концентрированная серная кислота способна отщепить от органических веществ водород и кислород в виде воды, обугливая органические вещества |
|
3. Реагирует с основными и амфотерными оксидами: H2SO4 + MgO ® MgSO4 + H2O 2H++SO42-+MgO®Mg2++SO42-+H2O 2H+ + MgO ® Mg2+ + H2O |
3. Характерной реакцией на серную кислоту и ее соли является взаимодействие с растворимыми солями бария: Н2SО4 + ВаСl2 ® BaSO4¯ +2HCl 2H+ + SO42- + Ba2+ + 2Cl- ® BaSO4¯ + 2Н+ + 2Сl- Ba2+ + SO42- ® BaSO4¯ Выпадает белый осадок, который не растворяется ни в воде, ни в концентрированной азотной кислоте |
|
4. Взаимодействует с основаниями: H2SO4 + 2KOH ® K2SO4 + 2H2O 2H+ + SO42- + 2K+ + 2OH- ® ® 2K+ + SO42- + 2H2O 2H+ + 2OH- ® 2H2O Если кислота взята в избытке, то образуется кислая соль: H2SO4+NaOH ® NaHSO4+H2O | |
|
5. Реагирует с солями, вытесняя из них другие кислоты: 3H2SO4+Ca3(PO4)2 ®3CaSO4+2H3PO4 | |
Применение. Серную кислоту широко применяют (рис. 3), она является основным продуктам химической промышленности.
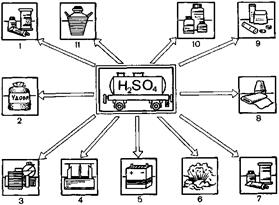
Рис. 3. Применение серной кислоты: 1 – получение красителей; 2 – минеральных удобрений; 3 – очистка нефтепродуктов; 4 – электролитическое получение меди; 5 – электролит в аккумуляторах; 6 – получение взрывчатых веществ; 7 – красителей; 8 – искусственного шелка; 9 — глюкозы; 10 — солей; 11 – кислот.
Серная кислота образует два ряда солей — средние и кислые:
Na2SО4 NaHSО4
сульфат натрия гидросульфат натрия
(средняя соль) (кислая соль)
Соли серной кислоты широко используют, например, Na2SO4×10H2O – кристаллогидрат сульфата натрия (глауберова соль) применяют в производстве соды, стекла, в медицине и ветеринарии. CaSO4×2H2O – кристаллогидрат сульфата кальция (природный гипс) – применяют для получения полуводного гипса, необходимого в строительстве, а в медицине – для накладывания гипсовых повязок. CuSO4×5H2O – кристаллогидрат сульфата меди (II) (медный купорос) – используют в борьбе с вредителями растений.
III. Закрепление нового материала
1. Зимой между рамами окон иногда помещают сосуд с концентрированной серной кислотой. С какой целью это делают, почему сосуд нельзя заполнять кислотой доверху?
2. Концентрированная серная кислота при нагревании реагирует с ртутью и серебром, подобно тому, как она реагирует с медью. Составьте уравнения этих реакций и укажите окислитель и восстановитель.
Статьи по педагогике:
Дайте краткую характеристику коммуникативным барьерам в процессе
педагогического общения
В процессе общения между учителем и учащимся стоит задача не только и не столько передать информацию, сколько добиться ее адекватного понимания последним. То есть в межличностной коммуникации как особая проблема выступает интерпретация сообщения, поступившего от учителя ученику и наоборот. Во-первы ...
Проектирование и организация индивидуальных занятий по
формированию санитарно-гигиенических навыков у детей с РДА
В соответствии с данными диагностического исследования, была спланирована и проведена работа по формированию санитарно-гигиенических навыков у детей с РДА. Обучение навыку предполагает целенаправленное формирование мотивационных, ориентировачно-операционных и регуляционных компонентов деятельности. ...
Физическое образование: его цели и задачи, содержание и структура
Система физического образования формировалась в многолетней практике изучения физики в общеобразовательных учебных заведениях. Усилиями поколений учителей и ученых школьный курс физики в ХХ в. вполне соответствовал лучшим мировым стандартам, способствовал достижению высокого уровня образованности н ...
Категории
- Главная
- Интенсивность труда
- Гуманная педагогика
- История педагогики и образования
- Уровень обучаемости
- Дистанционное обучение
- Система античного образования
- Образование и воспитание
