Опорные конспекты, схемы и таблицы по теме «Халькогены»
n (BaО2) = т /169, следовательно, n(О2) = т /(2 • 169).
Сравнивая количества вещества кислорода, которое получается в каждой реакции, делаем вывод, что максимальное количество, а значит, и объем этого вещества можно получить при разложении хлората калия.
Задача 5. Смесь равных масс алюминия и кислорода нагрели в закрытом сосуде в отсутствие воздуха. После окончания реакции к смеси веществ добавили такую же массу расплавленной серы. Во сколько раз масса исходной смеси отличается от массы полученной смеси веществ?
Решение
Пусть в реакцию вступили 100 г алюминия и 100 г кислорода. Найдем количества веществ:
n (Аl) = 100/27 = 3,7 моль;
n (О2) = 100/32 = 3,1 моль.
По уравнению реакции
4Аl + 3О2 = 2Аl2О3
с 3,7 моль алюминия прореагируют 2,8 моль кислорода. Следовательно, 0,3 моль кислорода останутся в избытке. Этот избыток кислорода будет взаимодействовать с серой: S + О2 = SO2
n (S) = 100/32 = 3,1 моль.
Количество вещества оксида серы(IV) будет равно 0,3 моль; 2,8 моль серы останется после реакции. Итак, по окончании всех реакций смесь будет содержать оксид алюминия (3,7/2 моль), серу (2,8 моль) и оксид серы(IV) (0,3 моль). Найдем массу этой смеси:
т = 1,85 • 102 + 2,8 • 32 + 0,3 • 64 = 298 г.
Масса исходных веществ равна 200 г. Масса полученной смеси больше массы исходных веществ примерно в 1,5 раза.
Задача 6. Через раствор массой 280 г, содержащий 0,02 массовые доли гидроксида калия, пропустили 2,24 л оксида серы(IV). Какая соль (кислая или средняя) образовалась? Какова ее масса?
Ответ. Кислая соль KHSO3 массой 12 г.
Задача 7. Какова массовая доля гидроксида натрия в растворе массой 200 г, если известно, что при пропускании сернистого газа через раствор образуется сульфит натрия массой 25,2 г? Ответ. 8%.
Задача 8. Рассчитайте массу серной кислоты, содержащейся в растворе объемом 2 л с массовой долей кислоты 0,98, плотность раствора 1,84 г/см3. Ответ. 3,6 кг.
Какой объем раствора серной кислоты концентрацией 0,25 моль/л вступает в реакцию с цинком, если при этом выделяется водород объемом 6,72 л (н. у.)? Ответ: 1,2 л.
Задача 10. При полном разложении 56,1 г смеси хлората калия и перманганата калия образовалось 8,96 л кислорода. Определите состав исходной смеси в % по массе.
Ответ. w (KMnO4) = 56,3%; w (KClO3) = 43,7%.
Задача 11. При нагревании 63,2 г перманганата калия получено 3,36 л кислорода. Определите степень разложения перманганата калия (в %) и количественный состав твердого остатка.
Ответ. Степень разложения KMnO4 – 75%; w (K2MnO4) = 50,6%; w (MnO2) = 22,3%; w (KMnO4) = 27,1%.
Задача 12. Вычислите объем раствора серной кислоты с массовой долей Н2SO4 96% (w= 1,84 г/мл), необходимого для приготовления 2 л раствора с молярной концентрацией 0,25 моль/л.
Ответ: 27,74 мл.
Далее учащимся на доске предлагаются задания для самоконтроля из следующих заданий:
1. Допишите уравнения практически осуществимых реакций:
а) Na2SO4 + KCl . ;
б) SO2 + Cа(ОН)2 . ;
в) Al + O2 . ;
г) KOH + H2SO4 . ;
д) Сu(OH)2 + SO3 . ;
е) Ba(OH)2 + H2S . ;
ж) H2SO4 + Cu . ;
з) CaSO4 + Ba(NO3)2 . ;
и) Na2SO3 + H2SO4 . ;
к) Al + H2SO4 (разб.) . .
2. Какие из предложенных веществ реагируют между собой:
Мg, Ва(ОН)2, SO3, Н2О, Сu(ОН)2, К2SO4, Н2SO4, Сu?
Напишите молекулярные и ионные уравнения реакций.
3. С какими веществами реагирует оксид серы(IV):
H2O, H2SO4, NаСl, NаОН, СаО, О2, Аl(ОН)3?
4. Напишите уравнения реакций следующих превращений:
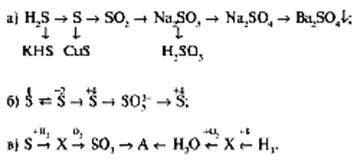
Установите формулы веществ А и Х.
5. Составьте схемы электронного баланса, расставьте коэффициенты в уравнениях реакций:
а) H2S + НNO2 S + NO + H2O;
б) Н2О2 + FeSO4 + Н2SO4 Fe2(SO4)3 + Н2О;
в) Na2O + NaI + Н2SO4 I2 + Na2SO4 + Н2О;
г) Н2SO4 + КВr K2SO4 + Вr2 + SO2 + Н2О;
д) Н2SO4 + NaI + NаNО3 I2 + NO + Na2SO4 + Н2О.
Система уроков по теме «Кислотные дожди» для 10–11 классов с углубленным изучением экологии
Цели:
раскрыть причины и механизм образования кислотных дождей;
показать их влияние на все компоненты биосферы, в том числе на человека;
обсудить основные методы снижения кислотообразующих выбросов в атмосферу.
На занятиях можно использовать аудиовизуальные технические средства обучения:
плакаты «Шкала кислотности», «Кислотные дожди», «Последствия кислотных дождей»;
дидактический раздаточный материал в виде таблицы, диаграммы источников выбросов в атмосферу оксидов серы и азота, схемы образования кислотных аэрозолей и дождей;
Статьи по педагогике:
Эффективность методов активного социально-психологического обучения в
условия ВУЗа
Методы социально-психологического обучения оказались наиболее продуктивными для студентов и взрослых поскольку они разумно используют жизненный и профессиональный опыт, в них учтены возрастные особенности психики. МАСПО, направленные на первичное овладение знаниями, способствуют развитию мышления, ...
Разработка уроков с применением методов обучения и их реализация в процессе
преподавания «Технологии» 8 класса»
Задача: С помощью объяснительно-иллюстративного метода рассказать ученикам о классификация брюк: прямые, расклешенные, зауженные к низу и т.д. Очень важно иметь наглядные пособия, либо находить их в одежде учеников. Орг. Момент: Эпиграф к уроку: « В человеке все должно быть прекрасно…» - Добрый ден ...
Особенности процесса развития воображения у детей с
нарушением слуха
Дети со слуховой депривацией уже на ранних этапах онтогенеза отстают от слышащих сверстников в развитии воображения, однако при наличии коррекционного обучения высокого качества учащиеся с нарушением слуха могут не только продемонстрировать аналогичный уровень развития воображения по сравнению с но ...
Категории
- Главная
- Интенсивность труда
- Гуманная педагогика
- История педагогики и образования
- Уровень обучаемости
- Дистанционное обучение
- Система античного образования
- Образование и воспитание
