Опорные конспекты, схемы и таблицы по теме «Халькогены»
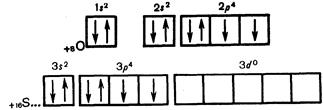
Таблица 4. Схемы строения атомов кислорода и серы
|
Химический знак |
Размещение электронов по энергетическим уровням |
Тканевые натяжные потолки цены и фото. Электронная формула |
|
О |
+8О 2е-, 6е- |
1s2 | 2s22p4 |
|
S |
+16S 2е-, 8е-, 6е- |
1s2 | 2s22p6 | 3s23p43d0 |
Размещение электронов по орбиталям
На наружном энергетическом уровне атомов всех элементов VI A группы находится по 6 электронов. До устойчивого энергетического состояния атома, характерного для благородных газов, недостает двух электронов, которые способны присоединять эти элементы. Поэтому кислород является одним из сильных окислителей: О0 + 2е-® О-2
Кислород в подавляющем большинстве соединений проявляет постоянную степень окисления –2. Исключением являются соединения OF2, где кислород имеет степень окисления +2, и пероксид водорода Н2О2, где кислород имеет степень окисления –1 (Н+1—О-1—О-1—Н+1). В подгруппе с возрастанием относительных атомных масс и увеличением атомных радиусов: а) закономерно уменьшаются неметаллические свойства; б) прочность водородных соединений падает; в) сила кислородных кислот уменьшается.
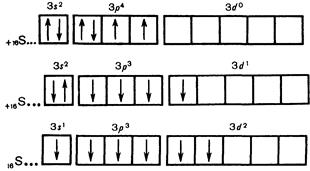
Таблица 5. Возможные степени окисления серы
|
Состояние атомов серы |
Размещение электронов по орбиталям |
Степень окисления |
|
Нормальное состояние Возбужденные состояния |
|
+ 2, - 2 + 4 + 6 |
У атомов серы на третьем энергетическом уровне имеется пять незаполненных d-орбиталей. Поэтому возможно распаривание электронов. В результате этого у атомов серы появляется либо четыре, либо шесть неспаренных электронов, которые при образовании соединений с более электроотрицательным элементом смещаются в его сторону (табл. 5). Этим объясняется степень окисления серы в соединениях с кислородом: S+4O2 и S+6O3.
III. Закрепление нового материала.
3.1 Ответьте на вопросы:
На основе теории строения атомов, используя таблицу, поясните, почему кислород является более сильным окислителем, чем сера. Почему кислород проявляет постоянную валентность?
Возможные степени окисления кислорода и серы.
Урок № 2. Сера, строение молекул, физические и химические свойства
Знать: аллотропные модификации серы; физические и химические свойства, получение и применение серы, оксидов серы(IV) и серы(VI), cерной кислоты, сульфатов; качественные реакции на сульфат- и сульфид-ионы; химические реакции, лежащие в основе производства серной кислоты; общие научные принципы химического производства.
Уметь: рассматривать в сравнении аллотропные модификации; записывать уравнения реакций, характеризующие свойства серы и ее соединений; рассматривать химические свойства веществ с точки зрения окислительно-восстановительных и ионных представлений.
Основные понятия: аллотропия, аллотропные модификации.
Ход урока
I. Организационный момент; проверка домашнего задания
II. Новый материал
1. Сера в природе и ее получение. В природе сера встречается как в свободном состоянии (сопутствует горным породам), так и в виде соединений. Важнейшие природные соединения серы показаны на схеме 1.
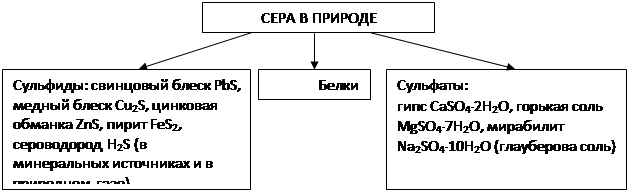 Схема 1
Схема 1
2. Получение. Для отделения серы в свободном состоянии от других горных пород пользуются ее легкоплавкостью (112,8°С).
3. Физические свойства серы. Сера – твердое кристаллическое вещество желтого цвета. Как неметалл, она плохо проводит теплоту и не проводит электрический ток. Кусочки серы тонут в воде – ее плотность близка к 2, а порошок серы всплывает (не смачивается водой). Подобно сере в измельченном состоянии водой не смачиваются многие соединения. Этим свойством пользуются для отделения сернистых руд от «пустой породы». Такой метод обогащения руд называется флотацией и используется на практике.
Сера хорошо растворяется в сероуглероде, толуоле и др. При температуре 112,8°С сера плавится, превращаясь в легкоподвижную жидкость желтого цвета. При дальнейшем нагревании она темнеет и густеет. При температуре 444 6 °С она закипает. Если нагретую до кипения серу вылить в холодную воду, то образуется пластическая сера, которая растягивается. Кристаллическая и пластическая сера – это аллотропные видоизменения химического элемента серы.
Статьи по педагогике:
Место темы в школьном курсе информатики и ее
содержание
Информатика - фундаментальная научная дисциплина. Объектом изучения информатики является система принципов и способов организации информационных процессов и технологий на базе компьютерных информационных систем, т.е. информатика изучает то общее, что свойственно всем многочисленным разновидностям к ...
Методический материал для проведения уроков по разделу «Культура
Средневековой Европы» в младшем подростковом возрасте
I. Художественная (творческая) деятельность При изучении темы «Романский стиль в архитектуре Средневековой Европы» учащимся в конце урока предлагается нарисовать замок, соблюдая все каноны Романского стиля. Свой рисунок нужно представить перед классом и дать ему описание. В качестве домашнего задан ...
Динимака экзаменационных заданий по типу и содержанию
Работа включает в себя 3 типа заданий (задания с выбором ответа, с кратким ответом, с развёрнутым ответом) и общее количество заданий равно 30 (в 2012 году предполагается сделать 31 задание) [3]. Изменение количества заданий экзаменационных работ по типу и по годам проведения представлены в таблице ...
Категории
- Главная
- Интенсивность труда
- Гуманная педагогика
- История педагогики и образования
- Уровень обучаемости
- Дистанционное обучение
- Система античного образования
- Образование и воспитание